|
|
||
Интроскопическая диагностика рецидива рака прямой кишки.
Хоружик С. А.1, Фомин К. А.2
1Гродненская областная клиническая больница, 2Гродненский медицинский институт.
В настоящее время отмечается рост заболеваемости раком прямой кишки.
Несмотря на совершенствование техники оперативного вмешательства, значительное
уменьшение послеоперационной летальности, отдаленные результаты хирургического
лечения за последние 20-30 лет остаются стабильными. Одной из основных
причин такого положения является рецидив опухоли, частота которого составляет
от 10 до 38% с продолжительностью безрецидивного периода 3-60 (в среднем
18) месяцев (1). Повторное хирургическое вмешательство при местном рецидиве
дает хороший паллиативный эффект, а при радикальном удаление рецидивной
опухоли может продлить жизнь. Следовательно, после первого оперативного
вмешательства по поводу рака прямой кишки пациенты нуждаются в активной
программе наблюдения, целями которой являются:
1. установить или отвергнуть наличие рецидива в ранней, потенциально
излечимой стадии;
2. установить возможность радикального удаления рецидивной опухоли.
В арсенале средств диагностики рецидива рака прямой кишки — полный набор лучевых методов: РКТ, МРТ, сцинтиграфия, а также колоноскопия, трансректальная и эндоскопическая сонография в отдельных случаях. Наиболее ранним тестом является серийное исследование карциноэмбрионического антигена (СЕА) в сыворотке крови. При повышенном уровне СЕА пациент нуждается в дальнейшем тщательном обследовании (2).
РКТ и МРТ имеют крайне низкую точность в выявлении первичного рака прямой кишки на ранних стадиях заболевания (Т1-2 N0-1 и ранние Т3 N0-1) и поэтому до операции широко не применяются. В то же время в диагностике рецидива опухоли после радикальной операции эти методы являются ведущими. Важно получить базисные сканы через 2-3 месяца после операции и повторять их через 6 месяцев, т. к. РКТ не может надежно определить, является ли мягкотканный участок в ложе удаленной опухоли рецидивом либо послеоперационными изменениями (3). Рубцовая ткань, даже если первоначально напоминает рецидив, со временем сокращается и через год ее размер должен уменьшиться, а границы стать резче. Увеличение образования или признаки аденопатии свидетельствуют о рецидиве. В отдельных случаях целесообразно дополнить РКТ-исследование биопсией.
В настоящее время активно развивается относительно молодое направление лучевой диагностики — ядерная медицина, находящая свое применение и в ранней диагностике рецидива рака прямой кишки. Небольшие рецидивные опухоли и опухолевые фокусы в лимфатических узлах могут быть выявлены с помощью позитронэмиссионной томографии и иммуносцинтиграфии. В частности сцинтиграфия с 99Тсm-меченными анти-СЕА моноклональными антителами у пациентов с повышенным уровнем сывороточного СЕА увеличила выявляемость рецидива на 25% и оказалась точнее РКТ в оценке резектабельности (4).
Целью нашего исследования было обобщить собственный опыт РКТ-исследований при подозрении на рецидив рака прямой кишки. В исследование были включены 16 пациентов, которым РКТ выполнялась в 1996-1998 годах. Возраст пациентов (6 женщин и 10 мужчин) был от 45 до 69 лет. У 15 человек выполнялась брюшнопромежностная экстирпация, в одном случае — операция Гартмана. 7 больным проводилась предоперационная лучевая терапия. Гистологически во всех случаях выявлена аденокарцинома разной степени дифференцировки. РКТ проводилась после предварительного тампонирования влагалища стерильным бинтом, обеспечивающим его “воздушность”. Для контрастирования петель тонкой кишки в нижних отделах брюшной полости за 2-3 часа до исследования давалось выпить 20 мл контрастного вещества с содержанием йода 240 мг/мл, разведенного в 200 мл воды.
Наши данные подтвердили сложность однозначной трактовки выявленных изменений.
У 5 пациентов убедительных данных за рецидив не было получено. Уже через
несколько месяцев после операции определялось смещение влагалища и матки
кзади (Рис. 1), смещение и деформация, натяжение в сторону рубца
задней стенки мочевого пузыря (этот признак нередко встречался и при рецидиве),
нечеткая дифференциация семенных пузырьков на фоне фиброзных изменений,
уплотнение клетчатки в проекции ложа прямой кишки (Рис. 2). Отсутствие
бугристого образования на этом фоне позволяло отвергнуть рецидив.
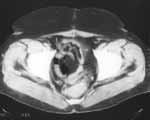
|
Рис. 1. Смещение матки к крестцу через 5 месяцев после оперативного лечения по поводу рака прямой кишки. |
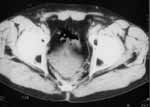
|
Рис. 2. Через 2 года после операции отмечается деформация и смещение кзади мочевого пузыря, фиброзные изменения предсакральной клетчатки. |
В 1 случае рецидив был признан вероятным ввиду нечеткости контуров тяжевидного образования в проекции ложа удаленной прямой кишки и рекомендовано РКТ-исследование в динамике.
У остальных пациентов в малом тазу выявлялось бугристое образование
мягкотканной плотности (в пределах 22-55 ед. Хаунсфилда). Структура его
нередко, но не всегда, была неоднородна за счет внутренней тяжистости и
наличия участков пониженной плотности (некроза) (Рис. 4) либо петрификатов
(Рис. 5). Контуры чаще были четкие. У одной пациентки заподозрено
прорастание задней стенки влагалища, подтвердившееся в дальнейшем при взятии
мазков. Еще у двух определялась резкая деформация и утолщение задней стенки
мочевого пузыря, вследствие чего нельзя было исключить вовлечение последнего
(Рис. 3). У одного пациента объемное образование находилось в тесном
контакте с семенными пузырьками (Рис. 4), у трех — с простатой.
РКТ позволяла определить отношение редидивной ткани к мышцам (Рис. 5)
и костным стенкам таза (контактное разрушение крестца в одном случае).
Необходимо заметить, что прилегание опухоли к окружающим структурам не
всегда означает их прорастание.
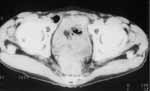
|
Рис. 3. Рецидив. Через 11 мес после операции между крестцом и мочевым пузырем определяется дополнительное мягкотканное образование. Семенные пузырьки не дифференцируются. Внутри опухоли участок снижения плотности - некроз. |
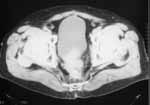
|
Рис. 4. Выбухание рецидивных масс в просвет мочевого пузыря. |
Единственный РКТ-критерий метастазирования в лимфатические узлы — морфологический,
т. е. их увеличение и характер контура. Для лимфатических узлов таза размер
более 1,5 см является порогом, выше которого метастатическое поражение
становится очень вероятным. Этот признак также не является специфичным:
даже неувеличенные лимфоузлы могут содержать опухолевые фокусы, а их увеличение
нередко носит реактивный характер. Нами выявлено увеличение паховых лимфоузлов
у двух пациентов (Рис. 5), наружных подвздошных — у одного. У одной
пациентки при отсутствии данных за местный рецидив определена генерализация
процесса с метастазированием в печень и конгломератом лимфоузлов на уровне
бифуркации аорты, вовлекающим левые подвздошные сосуды и мочеточник. В
одном случае выявлено метастатическое поражение костей таза (Рис. 6).
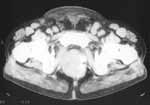
|
Рис. 5. Рецидивное образование прилежит к правой внутренней запирательной мышце. По левому контуру видны крупные петрификаты. Увеличение паховых лимфоузлов с двух сторон. |
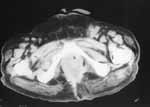
|
Рис. 6. Участок деструкции кортикальной пластинки нижней ветви правой лонной кости с мягкотканным компонентом (между стрелками). Увеличение левых паховых лимфатических узлов с экстракапсулярным ростом (метастазы). |
В нашем исследовании РКТ-признаки рецидива определялись в сроке от 10 до 28 (в среднем 18,8) месяцев после операции. РКТ позволила исключить рецидив у 5 пациентов (31%), выявить у 10 (62%), и заподозрить у 1 (7%), что дало возможность планировать дальнейшее лечение, в том числе определить объем повторного оперативного вмешательства.
Таким образом, РКТ является информативным и практически незаменимым методом диагностики рецидива рака прямой кишки. Общая продолжительность КТ-наблюдения пациентов после первой радикальной операции должна составлять не менее 2-3 лет, поскольку именно в этот период наиболее часто возникает рецидив. Ограничениями метода являются: плохая дифференциация небольшой рецидивной опухоли от рубцовой ткани (выход — РКТ в динамике либо биопсия); невозможность однозначного суждения о прорастании окружающих структур при наличии лишь прилегания или о метастазировании в лимфоузлы. Дальнейшее развитие комплекса лучевых методов ранней диагностики рецидива рака прямой кишки, безусловно, включит изотопное исследование. В сомнительных случаях должна выполняться биопсия.
Литература:
1. Кныш В. И., Ожиганов Е. Л., Тимофеев Ю. М. Понятие и классификация
рецидивов рака прямой кишки. // Вопросы онкологии.— 1987.— т. 33.— № 4.—
с. 36-41.
2. Sirisriro R. et al. 99Tcm-IMMU4 imaging in recurrent colorectal
cancer: efficacy and impact on surgical management. // Nucl-Med-Commun.—
1996.— vol. 17.— № 7.— p. 568-576.
3. Thoeni R. F. Colorectal cancer. Radiologic staging. // Radiol-Clin-North-Am.—
1997.— vol. 35.— № 2.— p. 457-485.
4. Hughes K. et al. Use of carcioembrionic antigen radioimmunodetection
and computed tomography for predicting the resectability of recurrent colorecal
cancer. // Ann.-Surg.— 1997.— vol. 226.— № 5.— p. 621-631.
|
||||||||