|
|
||
Дигитальная субтракционная ангиография.
Гончар А. А.1, Гончар И. А.2
15-ая больница г. Минск, 2НИИ неврологии, нейрохирургии и физиотерапии РБ.
Метод внутривенного введения рентгеноконтрастного вещества для визуализации камер сердца, системы легочной артерии и крупных сосудов был предложен в 1939 году и получил название внутривенной артериографии. В дальнейшем внутривенная инъекция контрастных веществ применялась для визуализации аорты, сонных артерий, сосудов почек. Однако клиническое использование внутривенной артериографии ограничивалось необходимостью введения больших доз контрастного вещества и недостаточно четкой визуализацией сосудов на фоне изображения мягких тканей и костей.
Дальнейшее совершенствование метода визуализации сосудов стало возможным при объединении рентгенографической техники с электронной и применении принципов субтракции («вычитания») и усиления изображения.
В итоге был создан принципиально новый метод визуализации сердечно-сосудистой системы, получивший название дигитальной субтракционной ангиографии (DSA).
Метод основан на внутривенном или внутриартериальном введении небольших доз контрастного вещества и усилении изображения контрастированных сердца и сосудов за счет компьютерной обработки и субтракции (исключения) неконтрастированных изображений объектов, не имеющих диагностической ценности — скелета, мягких тканей (Схема). Высокая разрешающая способность изображений, полученных данным методом, позволяет использовать меньшие дозы рентгеноконтрастных препаратов, либо производить инъекцию контраста в отдаленном от интересующего объекта месте.
Несмотря на значительное количество модификаций DSA, существующих в настоящее время, все их можно подразделить на три основные группы, объединяющим фактором которых служит то, какая из физических переменных (время, энергия, глубина) участвуют в процессе субтракции изображения. Если для формирования дифференцированного (итогового) изображения применяется одна физическая переменная, то процесс носит название субтракции «первого порядка», когда две и более — субтракции «второго порядка».
Специального рассмотрения заслуживает принцип временной субтракции, подразделяемой на традиционную субтракционную ангиографию, интегральный метод, соответственную и возвратную фильтрации. Принцип временной субтракции основывается на выполнении серии снимков за период с момента появления первой порции контрастного вещества до полного его исчезновения. Окончательное дифференцированное изображение формируется из разницы изображения с максимальной плотностью визуализации и «маски» — изображения с отсутствием контрастного вещества. Этот принцип положен в основу традиционной дигитальной ангиографии. Благодаря созданию видеодетектора и совершенствованию электронной техники появилась возможность фиксации изображения на кинопленку, видеопленку или оптический диск.
Современными модификациями традиционной дигитальной ангиографии являются
интегральный метод, соответственная и рекурсивная фильтрации. Основное
различие заключается в количестве изображений, используемых для получения
одного дифференцированного изображения.
Основой интегрального метода являются различия изображений «масковых»
и после контрастирования сосудов.
Соответственная фильтрация позволяет исключить изображения, содержащие нежелательные колебания сосудов.
При рекурсивной фильтрации в основе получения дифференцированного изображения лежит серия фрагментов, каждый из которых представляет собой комбинацию двух следующих друг за другом изображений.
Гибридная субтракция (субтракция «второго порядка») направлена на преодоление
движения мягких тканей и граничащих с сосудами органов. Основное достоинство
метода заключается в сглаживании артефактов, возникающих при глотательных
движениях, перистальтике кишечника, передаточной пульсации от камер сердца
и крупных сосудов. Основным недостатком является малое соотношение исходного
сигнала к «шуму».
Глубинная (томографическая) субтракция основана на выделении определенного
среза с помощью цифровых флюорографических систем.
Одним из достоинств DSA является малая лучевая нагрузка на пациента. Так, кожная доза при выборе позиции в течении 10 с, требующихся для рентгеноскопии, составляет 500 мР; тотальная экспозиционная доза — 3Р и средняя тканевая доза – 2 рад [2].
В процессе сопоставления доз рентгеновского излучения при традиционной ангиографии и DSA, выполненных в одинаковых условиях [3], получены следующие результаты. При обследовании больных с поражениями сонной артерии имели место двадцатикратное понижение лучевой нагрузки на костный мозг и хрусталик глаза и десятикратное – на щитовидную железу. При полипозиционном исследовании дуги аорты с помощью DSA было отмечено четырехкратное уменьшение дозы.
Кроме высоких диагностических возможностей, отмечаются и эксплуатационные преимущества этого метода. Существенно сократилось время проведения исследования и занятость персонала. Большинство исследований проводится силами одного врача. Управление аппаратурой осуществляется исследователем непосредственно из операционной при помощи выносного пульта. Изображение, пригодное для анализа, получают в реальном масштабе времени. Все это значительно повысило пропускную способность кабинета — до 6 исследований в 6-часовую смену. Кроме того следует отметить, что процесс получения DSА-изображения не связан с фотохимической обработкой рентгеновской пленки.
Наряду с широкими перспективами использования DSA, метод имеет и слабые стороны. К ним относятся малое поле изображения и невозможность выполнения одновременной биплановой ангиографии.
Следует указать ряд факторов, которые значительно влияют на качество изображения: чувствительность к двигательным артефактам, которая может мешать точному устранению фона. Но предварительная беседа с пациентом, фиксация исследуемой области, а также использование фильтров позволяют избежать артефактов. Эта проблема в последнее время решается путем повышения скорости регистрации, усовершенствованием вычислительной техники, применением фармакологических препаратов.
Существенным недостатком DSA является меньшая разрешающая способность, получение изображения, не соответствующего истинным размерам, и отсутствие связи выявленных изменений с анатомическими ориентирами. Первый из них обусловлен конструкцией аппаратуры: несмотря на самые совершенные установки, разрешающая способность DSA достигает только 2 пары линий на 1 мм, в то время как стандартная ангиография – 5 пар линий на 1 мм. Другие же недостатки устранимы. Соотношения полученного изображения с анатомическими ориентирами можно достичь путем регистрации на пленке двух изображений — «маски» и «заполнения». Для определения истинных размеров достаточно знать истинный наружный диаметр катетера, который может служить эталоном при рентгенометрии.
Показаниями к DSA являются поражения:
-сонных и церебральных артерий,
-грудной и брюшной аорты,
-почечных и висцеральных артерий,
-сосудов нижних конечностей,
-необходимость определения состояния внутриорганного русла паренхиматозных
органов,
-необходимость оценки состоятельности сосудов и органов после хирургических
вмешательств,
-невозможность или риск проведения исследования существующими ангиографическими
методами.
Амбулаторно внутривенная DSA выполняется при:
-артериальной гипертензии,
-гематурии,
-пальпируемой опухоли живота для уточнения взаимоотношения магистральных
артерий и вен,
-при опухолях шеи, полости рта и конечностей,
-при округлых тенях в корне или паренхиме легкого с целью исключения
их сосудистого генеза.
Сфера применения DSА и показания быстро расширяются. Доказательством этому служит применение DSA в педиатрической практике.
Применение DSA в качестве скрининг-метода не только позволяет уменьшить сроки обследования больных, но и выгодно экономически. При анализе обследования 38 больных с подозрением на вазоренальную гипертензию установлено, что применение DSA у пациентов этой группы понижает стоимость обследования почти в 3 раза по сравнению с таковой при использовании стандартных методов исследования [4].
Противопоказаниями к проведению DSA являются только абсолютная непереносимость йодсодержащих контрастных веществ и выраженная почечная и печеночная недостаточность.
Осложнения.
Возможные осложнения при DSA подразделяются на связанные с индивидуальной непереносимостью рентгеноконтрастного вещества и связанные с врачебными манипуляциями и режимами введения контрастного вещества. Они бывают обусловлены в основном несоответствием размеров вен и скорости инъекции, паравазальным введением контрастного вещества.
Режимы и способы введения контрастного вещества.
Контрастное вещество при DSA вводится внутривенно или внутриартериально. В первом случае контрастное вещество может быть инъецировано через иглу – посредством венепункции, через катетер, установленный в периферической вене или в системе верхней полой вены транскубитальным или трансфеморальным доступами, во втором – по общепринятой методике Сельдингера инъекцию осуществляют через катетер, введенный в аорту или селективно в артерию исследуемого органа. Введение контрастного вещества в малых дозах в артериальную систему используется для повышения информативности ангиографических исследований.
Объем и скорость инъекции контрастного вещества определяются:
1) местом введения,
2) минимально необходимой концентрацией контрастного вещества в сосудистом
русле,
3) состоянием сердечно-сосудистой системы пациента,
4) позицией катетера.
Величина содержания йода в артериальной крови должна быть не менее 2 мг на 1 см3. Следовательно, объем контрастного вещества при внутривенном его введении колеблется от 30 до 60 мл в среднем (из расчета 0,5-1 мл на 1 кг массы тела). Скорость инъекции контрастного вещества определяет «фронт» его распространения и колеблется от 10 до 25 мл/с. Ограничение скорости инъекции до 15 мл/с при введении контрастного вещества через иглу в периферические вены обусловлено возможностью возникновения осложнений в виде разрыва периферических вен и экстравазатов.
При расположении катетера в дистальных отделах периферических вен, подключичной, верхней полой, нижней полой или в правом предсердии скорость инъекции может быть увеличена до 30-35 мл/с.
Для достижения максимального эффекта инъекции, при введении контрастного вещества в периферические вены предложено в момент окончания инъекции дополнительно вводить 30-40 мл физиологического раствора или глюкозы при тех же скоростных режимах. С этой же целью разработаны модификации катетеров для субтракционной ангиографии. Это позволяет, в частности, значительно улучшить качество изображения у больных с признаками сердечной недостаточности, а также в тех случаях, когда контрастное вещество вводят в периферические вены либо в начальные отделы бедренной, подвздошной и подключичной вен. Не смешиваясь с контрастным веществом и поступая после него с той же скоростью, физиологический раствор служит своеобразным “поршнем”, изгоняющим болюс контрастного препарата.
Внутриартериальную инъекцию осуществляют через катетер, введенный по общепринятой методике в аорту или в артерию исследуемого органа. В случае использования этого доступа возможно уменьшение количества контрастного вещества при аортографии до 20 мл, при селективной артериографии в зависимости от исследуемого сосуда до 4-10 мл. Скорость инъекции — 4-10 мл/с.
Обычно при введении в артериальное русло контрастное вещество разводится вдвое физиологическим раствором. В последнее время в литературе появились сообщения о том, что неразбавленное контрастное вещество оказывает меньшее повреждающее действие на эндотелий сосудов. Основываясь на этих данных, ряд авторов вводят концентрированное контрастное вещество в малых дозах при селективных внутриартериальных исследованиях и получают более четкую картину мелкого сосудистого рисунка. Однако при внутриартериальном исследовании аорты и ее крупных ветвей введение значительного количества концентрированного вещества с большой скоростью уменьшает время изображения, что снижает информативность метода.
DSA сосудов головного мозга.
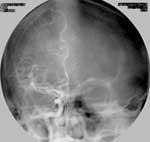
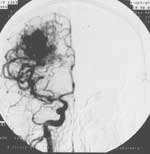
Около 80 % всех исследований, выполненных к настоящему времени с помощью DSA, посвящены изучению состояния сосудов головного мозга, и в том числе сонных артерий. Широкое применение DSA при исследовании сосудов головы и шеи объясняется возможностью получения высокого качества изображения (Рис. 2) при минимальной концентрации контрастного вещества (2-3%) в сосудах, в то время как для выполнения стандартной ангиографии (Рис. 1) содержание контрастного вещества в крови исследуемой артерии должно составлять не менее 40-50%.
При DSA головы и шеи выявляют:
-стенозы,
-атероматозные изъязвления,
-интра- и экстракраниально расположенные сосудистые мальформации,
-опухоли и метастазы,
-интракраниальные гематомы.
|
Рис. 1. Классическая ангиограмма. Артерио-венозная мальформация в правой теменной области, заполняющаяся из передней и средней мозговых артерий. Артериальная фаза, фронтальная проекция. |
|
Рис. 2. DS-ангиограмма того же больного. Артериальная фаза, фронтальная проекция. При меньшем расходе контрастного вещества сосудистая сеть видна гораздо лучше. |
|
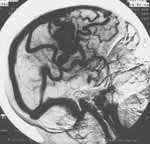
Рис. 3. DS-ангиограмма того же больного. Венозная фаза, правая боковая проекция. Четко визуализируется артерио-венозная мальформация в правой теменной области и множественные резко расширенные дренажные вены. |
Диагностическая ценность DSA (как и ангиографии) определяется числом используемых проекций. В косых проекциях можно определить состояние бифуркации сонной артерии в 62% и в боковых – в 37% случаев.
При изучении диагностических возможностей DSA в оценке состояния сонных артерий и сопоставления их с результатами обычной ангиографии выявлено, что чувствительность метода — 95%, специфичность – 99%, точность – 97% [1]. При слабой визуализации сосудов чувствительность составляет 54%, специфичность -54%, точность — 64%.
DSA имеет ведущее значение в оценке состояния внутричерепных вен и твердого
синуса (Рис. 3). Результаты исследований показали, что DSA позволяет
выявить:
-сдавление, смещение или окклюзию венозных структур;
-фистулы каротидно-кавернозного синуса;
-аномалии и варианты развития венозных структур;
-вторичные изменения вен при опухолях головного мозга.
Таким образом, DSA – высокоинформативный метод оценки состояния сердечно-сосудистой системы. Простота и безопасность метода, возможность его применения в амбулаторных условиях способствуют все более широкому его внедрению в клиническую практику.
Литература:
1. Восьмирко О.Д. Методические аспекты вычислительной субтракционной
ангиографии//Вестн. рентгенол.— 1989.-№4.-С.8-12.
2. Buonocore E.,Pavlicek W., Modik M.T. et al. – Ibid., 1983, v.147,
p.647-654.
3. Pfeiler M., Marhoff P. – Elektromedica, 1983, v. 53, p.20-31.
4. Hillman B.J., Ovitt T.W., Capp M.P. et al.— Radiologi,1982, v. 145,
p.643-646.
5. Anne G. Osborn.— Handbook of neuroradiology, 1991, p.500.
|
||||||||