|
|
||
Радионуклидная диагностика в онкологии.
Медведский В. Е., Гренков Г. И., Щербинин Ю. И., Павлова Л. А.
Витебский медицинский институт.
Применение радионуклидных методов диагностики в онкологической практике
определяется объемом поставленных задач. При использовании любых диагностических
методов, для успешного лечения онкологических больных, должны быть решены
следующие задачи:
- есть опухоль или нет (ранняя диагностика опухолей),
- злокачественная опухоль или доброкачественная (дифференциальная диагностика
опухолей),
- определение стадии заболевания по системе TNM,
а)определение размеров опухоли (Т 0-4),
б)определение метастазов в регионарные лимфоузлы (N0-3),
в)определение метастазов в другие органы (М 0-1),
- оценка функционального состояния других органов и систем,
- контроль за эффективностью проведенного лечения,
- ранняя диагностика рецидивов и метастазов опухоли.
Визуализация опухолей.
Многие из перечисленных задач решаются методами радионуклидной диагностики, связанными с визуализацией опухолей. Визуализация злокачественных новообразований основана на различии накопления препарата в опухоли и окружающей ее ткани. В одном случае опухоли приобретают способность повышенного накопления препарата по сравнению со здоровой тканью. Такие образования выявляются в виде "горячих" очагов. В другом — теряют способность ткани накапливать тот или иной препарат. Эти опухоли определяются в виде "холодных" очагов. Соответственно группы радиофармпрепаратов, используемые для визуализации опухолей, называются "туморотропными" и "органотропными".
Органотропные соединения индивидуальны для визуализации каждого органа:
пертехнетат Тс-99м — для щитовидной железы, коллоидные растворы — для печени,
макроагрегат альбумина — для легких, ДМСА — для почек и т.д. Современная
аппаратура позволяет проводить полипозиционное исследование органа в короткое
время, что увеличивает возможность выявления опухолевого процесса (Рис.
1) и даже проводить эмиссионную компьютерную томографию для послойного
изучения распределения препарата в органе в различных проекциях.
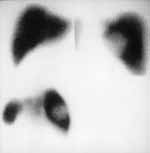
|
Рис. 1. Сцинтиграфия печени с коллоидом технеция-99м в трех проекциях. Дефект накопления не виден в передней проекции и хорошо определяется в правой боковой и задней проекции. |
Туморотропные препараты в свою очередь можно условно разделить на специфичные и неспецифичные. Специфичность препарата оценивается не по отношению к определенному органу, а к опухолевому процессу.
Из специфичных туморотропных препаратов следует отметить цитрат галлия-67.
С этим препаратом можно получить изображение опухолей в виде горячих очагов
большинства органов (челюстно-лицевой области, гортани, пищевода, легких,
мягких тканей, печени, молочной железы). Особенно ценен этот метод в диагностике
заболеваний лимфоидной ткани (лимфогрануломатоз, лимфосаркома). Это связано
с тем, что при системном заболевании надо оценить состояние всех групп
лимфоузлов выше и ниже диафрагмы. Такое возможно только при использовании
цитрата галлия, когда после однократного введения препарата визуализируются
только пораженные лимфоузлы, независимо от их локализации. Другие методы
исследования (медиастиноскопия, прямая и непрямая лимфография, томография,
ультразвуковая диагностика) позволяют исследовать только отдельные группы
лимфоузлов. Кроме того, при исследовании с цитратом галлия удается в некоторых
случаях определить и органное поражение желудка, печени, легких. Исследование
с цитратом галлия эффективно для контроля за проведенным лечением (Рис.
2). К сожалению, этот препарат не позволяет достоверно диагностировать
опухоли брюшной полости, потому что выведение препарата осуществляется
через кишечник и активность препарата в кишечнике маскирует повышенное
накопление препарата в опухоли. Аналогично цитрату галлия-67 применение
блеомицина, меченного индием-111.
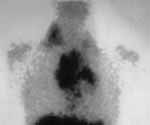
|
Рис. 2. Сцинтиграфия
с цитратом галия-67 при лимфогрануломатозе.
(Слева) До лечения отмечается повышенное накопление препарата в надключичных лимфоузлах справа и лимфоузлах средостения. (Справа) После лечения очаги повышенного накопления препарата отсутствуют. |
|
В последние годы для визуализации опухолей стали использовать меченные йод-131 моноклональные антитела. Эти препараты имеют специфичность не только к опухолевому процессу, но и к определенному органу. Например, СА-125 позволяет увидеть опухоли яичников, смесь РЭА и СА-199 — опухоли кишечника и печени.
Неспецифические туморотропные препараты позволяют визуализировать опухоли
только отдельных органов, причем повышенное накопление препарата в них
связано не с опухолевым процессом, а с другими причинами.
Типичным примером таких препаратов является йодид натрия, меченный
йод-131, используемый для диагностики метастазов рака щитовидной железы
в другие органы: легкие, кости и др. Причиной повышенного накопления препарата
в метастазах в данном случае является остаточная способность их выполнять
функцию материнской ткани синтезировать гормоны для которых необходим йод.
Но так как эта функция очень низкая, перед исследованием необходимо подавить
функцию самой щитовидной железы (хирургическим, лучевым или медикаментозным
путем) и стимулировать функцию метастазов введением тиреотропного гормона.
В виде горячих очагов визуализируются также опухоли головного мозга, опухоли
костей, забрюшинные опухоли (Рис. 3).
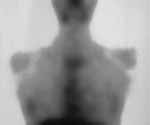
|
Рис. 3. Сцинтиграфия опухолей забрюшинного пространства. Определяется смещение правой почки книзу опухолью надпочечника. |
Визуализация опухолей скелета, особенно вторичных, с использованием
фосфатов технеция-99м имеет преимущества перед другими методами, поскольку
визуализация возможна на уровне нарушения минерального обмена, а не разрушении
костной структуры. Поэтому радионуклидный метод при данной патологии опережает,
например, рентгенологический метод от 3-6 месяцев до года (Рис. 4).
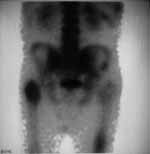
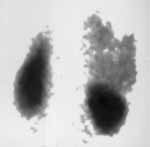
|
Рис. 4. Метастазы
в кости, выявляемые раньше на сцинтиграммах.
(Слева) Повышенное накопление препарата в верхнюю треть правой и среднюю треть левой бедренной кости. (Справа) Рентгенограмма тех же отделов скелета без признаков поражения. |
|
К туморотропным препаратам можно отнести и двузамещенный фосфат натрия, меченный йодом-131. Однако, распад радиоактивного фосфора-32 сопровождается излучением только бета-частиц, поэтому с ним нельзя проводить визуализацию опухолей и даже для радиометрии датчик следует подводить непосредственно к самой опухоли. По этой причине радиофосфорная диагностика ограничивается исследованием подозрительных образований кожи и некоторых полых органов (пищевод, полость рта, носа, гортани, прямая кишка, матка) в целях дифференциальной диагностики. В настоящее время этот метод незаменим для дифференциальной диагностики меланом кожи, глаза.
Определение опухолевых маркеров.
Использование "in vitro" методов исследования в онкологии подразумевает определение в сыворотке (плазме) крови опухолевых маркеров, повышенное содержание которых указывает на наличие опухолевого процесса.
Этот метод привлекателен для ранней диагностики заболевания, так как
не имеет противопоказаний и по техническим характеристикам может быть использован
для массового обследования населения. Но до настоящего времени не получено
опухолевых маркеров со специфичностью, позволяющей использовать их при
профилактических осмотрах. Максимальной возможностью при массовом обследовании
является выделение "группы риска". Поэтому применение радиоиммунных методов
в онкологии проводится в основном для решения следующих задач:
-дифференциальная диагностика опухолей (как дополнительный признак),
-прогнозирование заболевания,
-оценка эффективности проведенного лечения,
-раннее выявление рецидивов и метастазов опухоли.
Практическое применение в настоящее время получило определение следующих
маркеров.
- Альфа-фетопротеин (АФП) — гликопротеин с содержанием в плазме крови
здоровых людей 2-10 мкг/л. Стойкое увеличение концентрации АФП характерно
для гепатоцеллюлярного рака печени и метастазов в печень. Временное повышение
уровня АФП может отмечаться при вирусном гепатите, циррозе.
- Раковоэмбриональный антиген (РЭА) — гликопротеин с содержанием в
плазме крови здоровых людей 0-12 мкг/л. Повышенное содержание РЭА характерно
для опухолей желудочно-кишечного тракта, печени, хотя он может быть увеличен
и при злокачественных опухолях других локализаций и даже при заболеваниях
неопухолевой природы.
- Хорионгонадотропный гормон (ХГТГ) — гликопротеин, синтезирующийся
клетками плаценты с ранних сроков беременности. При отсутствии беременности
увеличение ХГТГ характерно для хорионэпителиомы матки.
- Тироглобулин (ТГ) и антитела к тироглобулину (АТГ) определяют
для диагностики рака щитовидной железы.
- Моноклональные антитела — антитела, вырабатываемые одним клоном клеток.
Обладают молекулярной идентичностью и специфичностью, взаимодействуют только
с одним антигеном.
Получены и выпускаются коммерческие наборы по определению моноклональных
антител к опухолям яичников (СА-125), поджелудочной железы (СА-199), молочной
железы (СА-153). Поскольку увеличение содержания вышеуказанных маркеров
в сыворотке или в плазме крови может наблюдаться и при заболеваниях неопухолевой
природы, для каждого маркера устанавливаются не только нормальные показатели,
но и пороговый (критический) уровень, превышение которого служит признаком
наличия опухолевого процесса. С увеличением концентрации маркеров выше
порогового ухудшается прогноз заболевания. Об эффективности проведенного
лечения судят по степени снижения концентрации маркеров в крови. При радикальном
лечении их уровень опускается ниже критического, часто до нормы. Повторный
подъем маркеров в крови после успешно проведенного лечения является признаком
наличия рецидива заболевания или метастазов.
|
||||||||